
Az Ideggyógyászati Szemle 74. évfolyama letölthető PDF formátumban: Letöltés
ÖSSZEFOGLALÓ KÖZLEMÉNY
ILLÉS Zsolt 1, 2
1Pécsi Tudományegyetem, Neurológiai Klinika, Pécs
2Department of Neurology, Odense University Hospital, University of Southern Denmark, Odense, Dánia
A neuromyelitis optica spektrum betegség (NMOSD) az esetek körülbelül 80%-ában AQP4-ellenanyaggal társul. A szeronegatív betegek körülbelül negyedében a központi idegrendszeri myelin oligodendrocyta glikoprotein (MOG) ellen mutatható ki ellenanyag, és ez a kórkép a MOG-ellenanyag-asszociált betegség (MOGAD) elnevezést kapta. Jelen közlemény áttekinti az off-label azathioprin és mycophenolat mofetil, valamint az evidenciákon alapuló B- és plazmasejt-depletio, az IL-6-jelátvitel és a komplement útvonal antagonizálás klinikai aspektusait NMOSD-ben. Az összefoglaló tárgyalja az NMOSD-terápia terhességi vonatkozásait, és a MOGAD – NMOSD-től eltérő – kezelési megközelítését. Az NMOSD kezelése kapcsán az utóbbi két évben több, III. fázisú klinikai tanulmányon alapuló I. osztályú evidencia jelent meg. A monoklonális ellenanyagokkal végzett vizsgálatok a rituximab (anti-CD20), az inebilizumab (antiCD19), a tocilizumab (anti-IL6R), a satralizumab (anti-IL6R) és az eculizumab (anti-C5) hatékonyságát és biztonságosságát jelzik egyéb immunterápiákkal kombinálva vagy monoterápiában. A MOGAD kezelését bonyolítja, hogy az esetek körülbelül fele monofázisos, és a MOG ellenanyag a betegség lefolyása során spontán vagy kezelés hatására eltűnhet. A tartós immunszuppresszió igényét MOGAD-ban a relapsusterápiát követő, leépített orális szteroidkezelés után célszerű eldönteni. NMOSD-ben a fenntartó terápia folytatása javasolt terhesség és szoptatás alatt is, és ezt az optimális kezelés kiválasztásánál fertilis nőbetegeknél figyelembe kell venni. Az új evidenciák terápiarezisztens NMOSD-ben is több lehetőséget kínálnak, és a MOGAD kezelési stratégiája is körvonalazódik.
TREATMENT AND NEW EVIDENCES IN NEUROMYELITIS OPTICA SPECTRUM DISORDER
Illés Zs, MD, PhD
Ideggyogy Sz 2021;74(9–10):309–321.
Neuromyelitis optica spectrum disorder (NMOSD) is associated with antibodies against AQP4 in about 80% of the cases. In about one-fourth of seronegative cases, antibodies against the MOG protein are present in the serum (MOG-antibody associated disease, MOGAD).
This article discusses off-label azathioprine and mycophenolate mofetil in the treatment of NMOSD and reviews the evidence-based clinical aspects of B/plasma cell depletion, antagonization of IL-6 signaling and blocking the complement pathway. The review also summarizes basic aspects of NMOSD pregnancy focusing on treatment, and the different therapeutic approach in MOGAD. In the recent two years, phase 3 clinical trials provided class I evidence for the efficacy and safety of rituximab (anti-CD20), inebilizumab (anti-CD19), tocilizumab (antiIL6R), satralizumab (anti-IL6R), and eculizumab (anti-C5) in combination with other immunosuppressants or in monotherapy.
The treatment approach in MOGAD is complicated by the monophasic course in about half of the cases and by the potential disappearance of MOG antibody. The necessity of maintenance treatment in MOGAD should be decided after tapered oral steroid. Immunosuppression is recommended in NMOSD during pregnancy and lactation, and this should be considered for optimal selection of treatment in fertile female patients. The new monoclonal antibodies broadened treatment options NMOSD, and the treatment strategy of MOGAD has become more straightforward.
Levelezési cím (correspondence): Dr. Zsolt ILLÉS, Department of Neurology,
Odense University Hospital; Winslows Vej 4, Odense 5000, Denmark.
E-mail: zsolt.illes@rsyd.dk
https://www.orcid.hu/0000-0001-9655-0450
Érkezett: 2021. július 1. Elfogadva: 2021. július 26.
Ideggyogy Sz 2021;74(9–10):309–321.
A neuromyelitis spektrum betegség (NMOSD) a központi idegrendszer gyulladásos, demyelinisatiós kórképe1. Ritka kórkép: Európában a prevalencia 0,7–1/100 000, kivéve Magyarországot, ahol a prevalencia majdnem kétszeres (1,9/100 000)2, 3. A magyar esetek 84%-a társul az agyi vízcsatorna, az AQP4 molekula elleni specifikus ellenanyaggal2.
A betegség patomechanizmusában alapvető szerepet játszik az astrocyta AQP4 molekulájához kötődő, CD19+ plazmasejtek által termelt ellenanyag, mely komplementet aktivál, és az astrocyta lysisét okozza4, 5. Fontosak emellett a granulocyták, a gyulladáskeltő IL-6 citokin, és valószínűleg a T-sejtek is, melyek aktivációjában a CD20+ B-sejtek szerepe is felmerül6–8. A CD4+ Th1-sejtek ugyanakkor szerepet játszanak az immunglobulin-osztályváltásban, és a komplementet aktiváló IgG1 alosztályú AQP4-ellenanyagok generálásában. Egy másik CD4+ T-sejt-alcsoport, az erősen gyulladáskeltő Th17 sejtek aránya NMOSD-ben emelkedett, és az IL-6 fontos a Th17 és az ellenanyag-termelő B-sejtek érésében a vér-agy gát roncsoló hatása mellett9, 10 (1. ábra).

1. ábra. Az NMOSD evidenciaalapú terápiája. Az utóbbi két évben öt monoklonális ellenanyag-terápia II/III. fázisú vizsgálatának eredményeit publikálták, melyek az NMOSD mechanizmusának négy különbözô komponensét támadják: (1) az IL-6 hatását két anti-IL6R ellenanyag antagonizálja, a satralizumab és a tocilizumab. Az IL-6 fontos az ellenanyagot termelô plazmasejtek érésében, a gyulladáskeltô Th17 sejtek generálásában, a macrophagok aktiválódásában és a vér-agy gát sérülésében. A vér-agy gát sérülés miatt gyulladáskeltô citokinek, granulocyták, NK-sejtek, komplementkomponensek jutnak a központi idegrendszerbe, melyek hozzájárulnak a gyulladáshoz és az astrocytapusztuláshoz. Ez másodlagos demyelinisatiót okoz. (2) A B-sejtek depletiója az anti-CD20 rituximabbal csökkenti az antigénbemutatást, a T-sejtek aktivációját és a gyulladáskeltô citokinek termelését. (3) A B- és a plazmasejtek depletiója az anti-CD19 inebilizumabbal az elôzôek mellett a patogén anti-AQP4 ellenanyag-termelést is redukálja. (4) A perifériás plazmasejtek által termelt AQP4-ellenanyag az astrocyták AQP4 molekulájához kötôdik, és komplementet aktivál. A C5 komplementkomponens elleni eculizumab a gyulladáskeltô C5a és a membránattak-komponens (MAC) keletkezésében fontos C5b képzôdését akadályozza meg. (Az ábra Biorender programmal készült.)
Az AQP4-ellenanyaggal nem rendelkező betegek körülbelül negyedében a szérumban a myelin oligodendrocyta glikoprotein (MOG) ellen mutatható ki antitest, mely az NMOSD-vel szemben nem astrocytopathiához, hanem oligodendrocyta-laesióhoz vezet (2. ábra). E betegség a közelmúltban a MOGAD elnevezést kapta (MOG-antibody associated disease). A MOGAD valószínűleg kétszer gyakoribb, mint az NMOSD, bár epidemiológiai vizsgálatát bonyolítja a monofázisos lefolyás az esetek felében, és az ellenanyagok potenciális eltűnése spontán vagy szteroidkezelést követően11, 12.

2. ábra. A MOGAD mechanizmusa. A perifériás plazmasejtek által termelt MOG-ellenanyag az oligodendrocyta és a myelin MOG- (myelin oligodendrocyta glikoprotein) proteinjével reagál, és feltehetôen komplementaktiváció révén okozza a myelin és talán az oligodendrocyta laesióját. (Az ábra Biorender programmal készült.)
Az NMOSD diagnózis a 2015-ös nemzetközi (IPND) kritériumok alapján felállítható, ha a betegnél ellananyag mutatható ki az AQP4 molekula ellen, és hatból legalább egy klinikai kritérium jelen van: a leggyakoribb az opticus neuritis, a myelitis és az area postrema szindróma. Ha az ellenanyag nem mutatható ki, akkor legalább egy klinikai kritérium szükséges a fenti háromból, és egy további a hat klinikai kritériumból térbeli disszeminációval és MRI-vel is támogatva (1. táblázat)13.
MOGAD nemzetközi kritériumok korlátozottan állnak rendelkezésre, és a Mayo Klinika által javasolt hasonló kritériumrendszert általánosan egyelőre szintén nem fogadták el (1. táblázat)14.

1. táblázat. NMOSD és MOGAD diagnosztikai kritériumok
LETM: kiterjedt, ≥3 csigolyahossz laesio vagy atrófia; ADEM: akut disszeminált encephalitis; CRION: krónikus relapszáló opticus
neuritis (szteroidfüggô); STM: rövid kiterjedésû myelitis
*sejtalapú esszével (CBA)
Az NMOSD kezelése 2019. júniusig esettanulmányokon és konszenzusközleményeken alapult. Az SM kezelésében alkalmazott interferon-β, fingolimod, alemtuzumab és natalizumab NMOSDben nem hatékony, sőt betegségaktivitáshoz vezethet NMOSD-ben és MOGAD-ban egyaránt15.
Az NMOSD egy további terápiás aspektusa szintén eltér az SM kezelésétől: míg hasonlóan az SM-hez a post partum periódus első trimeszterében fokozza a relapsus kockázatát, a terhesség – az SM-mel ellentétben – nem véd az aktivitás ellen, és az NMOSD-t akár a betegek 20%-ában a terhesség alatt diagnosztizálják16–19. Ezért a terápia folytatása fontos lehet terhesség és szoptatás alatt is, így az egyes NMOSD-terápiák magzatra és újszülöttre gyakorolt hatása alapvetően befolyásolhatja a kezelési tervet. Az NMOSD az SM-mel ellentétben körülbelül tízszeresére fokozza a spontán abortusz kockázatát is, mivel az AQP4 molekula a placentában is expresszálódik20, 21.
A közelmúltban hat randolmizált klinikai tanulmány adatait közölték NMOSD-ben: öt monoklonális ellenanyag terápia – melyek négy különböző molekulát és három útvonalat támadnak – nyújt első alkalommal I. osztályú evidenciát az NMOSD kezelésében (1. és 3. ábra)22.
Az alábbiakban röviden összefoglalom az NMOSD terápiás lehetőségeit elsősorban az új, evidenciaalapú kezelésekre és a terhességi kérdésekre fókuszálva, és röviden tárgyalom a MOGAD – kevésbé egyértelmű – terápiás megközelítését.
Tradicionális immunszuppresszívumok és autológőssejt-transzplantáció (HSCT)
Az azathioprin (AZA) és a mycophenolat mofetil (MMF) szteroiddal kombinálva vagy monoterápiában hosszú éveken át az NMOSD alapvető terápiái voltak. Az AZA gyógyszerelőanyag, melynek az aktív metabolitja gátolja a purinszintézist és a lymphocytaproliferációt, és a DNS-replikáció zavara miatt T- és B-sejt-apoptózishoz vezet. Retrospektív amerikai és brazil tanulmányokban az éves relapsusráta (ARR) 1,5-ről 0,2-re, illetve 5-ről 1-re csökkent (76% és 70% csökkenés)23–25. Az amerikai kohortban azonban a betegek egyharmada abbahagyta a kezelést mellékhatások miatt23. Fej-fej melletti II. fázisú és nyílt vagy kohort tanulmányokban a hatékonysága rosszabb volt az anti-CD20 rituximabnál (RTX), az anti-IL6R tocilizumabnál és az MMF-nél is, és a betegek az AZA-t tolerálták a legkevésbé RTX-hoz és MMF-hoz hasonlítva: az ARR-csökkenés AZA mellett 40% (vs. 79% RTX és 64% MMF), 53% (vs. 96% RTX és 83% MMF), 72% (vs. 88% RTX és 87% MMF) volt26–31. A TANGO II. fázisú tanulmányban az AZA-relapsuskockázat 47%, egy randomizált nyitott tanulmányban pedig az ARR-csökkenés 50% volt27, 28. Metaanalízisben az RTX hatékonyabban csökkentette az ARR-t, mint az AZA32 . Bár a placentán átlép, a magzatban az aktív metabolitok generálásához szükséges enzimek hiányoznak. Szakértői ajánlás hangsúlyozza, hogy több mint 2000 terhességi adat az AZA viszonylagos biztonságát sugallja, de gyakoribb a koraszülöttség, az alacsonyabb testsúly és az újszülött csontvelő-szuppressziója22, 33–35. Az amerikai reumatológiai társaság (ACR) erősen javasolja az AZA-t terhesség alatt reumatológiai kórképekben, és a körülményektől függően szoptatás alatt is, mert az anyatejben nem vagy nagyon alacsony koncentrációban mutatható ki36. Az AZA céldózisa 2,5–3 mg/ttkg naponta, de legalább 6 hónapig nagy dózisú szteroid adása is szükséges a hatékonyság eléréséhez, majd ezt követően 3–6 hónap alatt építhető le a szteroid37. Az NMOSD-betegek egy részében alacsony dózisú szteroid és azathioprin kombináció szükséges a remisszió fenntartásához. Az MMF szintén előanyag, aminek az aktív metabolitja, a guanozin nukleotidszintézisben és így a lymphocytaproliferációban részt vevő inozin monofoszfát dehidrogenáz enzimet gátolja reverzibilisen. Retrospektív NMOSD-tanulmányokban az ARR körülbelül 80-90%-kal javult38, 39; hatékonysága kohortokban és metaanalízisben a rituximabhoz (RTX) hasonló, és jobb az AZA-nál29–32.
A 25–36%-os hatástalanságráta szintén a RTXéhez hasonló29, 38. Retrospektív kohortanalízisben a betegek az MFF-et tolerálták a legjobban AZA-hoz és RTX-hoz hasonlítva, és a betegek körülbelül negyede-ötöde hagyta abba a kezelést mellékhatás miatt32, 39, 40. Az MMF céldózisa 2000 mg naponta, bár egy kínai tanulmány a napi 1000 mg dózist is hatékonynak találta38. Legalább három hónapig szintén szteroiddal kell kombinálni. Terhesség alatt nem adható, mivel a major foetalis malformatio 26%, és a spontán abortusz is 45%; a tervezett koncepció előtt legalább 6 héttel le kell állítani41. Ezért fertilis NMOSD-s nőbetegekben egyéb terápiák részesítendők előnyben.
Egyéb immunszuppresszívumokkal kapcsolatban kevés adat áll rendelkezésre. A methotrexat (MTX) a nukleotidszintézist gátolja. Kisszámú kohortokban az ARR 1,4-ről 0,2-re és 3,1-ről 1,1-re csökkent, a betegek 43%-a volt relapsusmentes42.
A mitoxantron 75%-kal csökkentette a relapsusrátát átlagosan 41 hónap alatt 20 betegben43. A ciklofoszfamiddal kapcsolatban ellentétes adatokat publikáltak, csökkent vagy változatlan aktivitással44, 45.
E három kezelés teratogén, ezért nőkben e terápiák nem javasoltak az NMOSD kezelésére. A HSCT hatékonysága a kis esetszámú limitált tanulmányban a kondicionáló terápiától függhet.
A legutóbbi, prospektív tanulmányban non-myeloablatáló rezsim 12 betegnél medián 57 hónapon át relapsusmentességet eredményezett, és a betegek többségénél az AQP4-ellenanyag is eltűnt46.
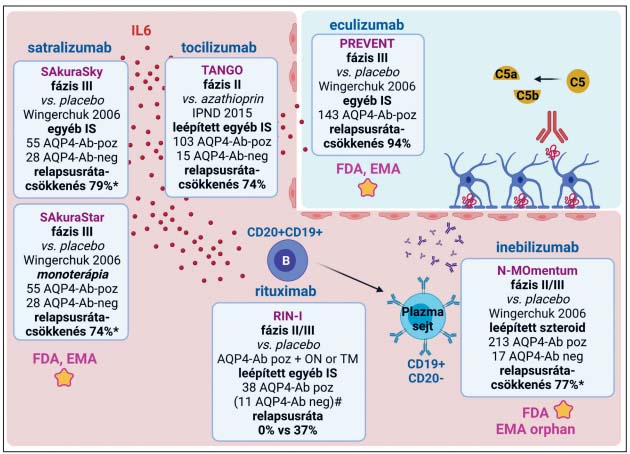
3. ábra. Monoklonális ellenanyag-terápiák az NMOSD kezelésében. Két anti-IL-6R ellenanyaggal zajlott klinikai tanulmány. A satralizumabot hozzáadott kezelésként és monoterápiában is vizsgálták placebóval szemben a két III. fázisú SAkura tanulmányban. Ezek eredményeként az FDA és az EMA elfogadta a satralizumabot az AQP4-ellenanyag-pozitív NMOSD kezelésére. A tocilizumabot a II. fázisú TANGO tanulmányban vizsgálták azathioprinnal szemben; valamennyi beteg 12–24 hétig egyéb immunszuppresszív kezelést is kapott. A B-sejt-depletáló anti-CD20 rituximabot a II/III. fázisú RIN-I tanulmányban vizsgálták placebóval szemben; valamennyi beteg orális szteroidkezelésben is részesült. A B- és a plazmasejteket depletáló anti-CD19 inebilizumabot a II/III. fázisú N-MOmentum tanulmányban vizsgálták placebóval szemben; a betegek 21 nap alatt leépített szteroidot is kaptak. Az inebilizumabot az FDA és az EMA elfogadta az AQP4-ellenanyag-pozitív NMOSD kezelésére. A komplement C5 komponensét antagonizáló eculizumabot a III. fázisú PREVENT tanulmányban vizsgálták placebóval szemben. A betegek folytatták a korábbi immunszuppresszív kezelést. Az FDA és az EMA elfogadta az eculizumabot az AQP4-ellenanyag-pozitív NMOSD kezelésére. (Az ábra Biorender programmal készült.)
*Az AQP4-ellenanyag-pozitív betegek relapsuscsökkenése; # korábbi AQP4-ellenanyag-pozitivitás az anamnézisben
kötelezô volt, de beválasztáskor 11 beteg szeronegatív volt.
Interleukin-6-útvonal-gátlók
A gyulladáskeltő IL-6 citokin, ami az IL-6-receptoron (IL-6R) keresztül hat, stimulálja a B-sejteket, részt vesz a gyulladáskeltő Th17-sejtek és az ellenanyag-termelő plazmasejtek generálásában, valamint hozzájárul a vér-agy gát pusztulásához, a gyulladás propagálásához, és az AQP4-ellenanyagtermeléshez NMOSD-ben. Az IL-6-szint a betegek vérében és liquorában emelkedett, és korrelál az AQP4-ellenanyag-szinttel és a betegség súlyosságával (1. ábra)7, 22, 47. A tocilizumab volt az első humanizált monoklonális ellenanyag az IL-6R ellen, melyet a körülbelül 10 éve a rheumatoid arthritis, az óriássejtes arteritis és a citokinfelszabadulás-szindróma kezelésére alkalmaznak részben MTX-szel kombinálva. Mellékhatásai ezért jól ismertek: mérsékelt lipoprotein-emelkedés és neutropeniakockázat48. Súlyos infekciók a dán és svéd regiszterben a RTX-hez képest kevésbé fordultak elő, szemben a brit regiszterrel49, 50.
NMOSD-ben sem az FDA, sem az EMA nem fontolta meg a tocilizumab alkalmazását, bár kisebb japán és német kohort tanulmányok és a TANGO vizsgálat hatékonyságát jelezte.
A TANGO tanulmány (3. ábra) nyitott, többközpontú, randomizált II. fázisú vizsgálat volt, melyben 118 kínai NMOSD-beteget (IPND 2015 kritérium)13 követtek 90 héten át havonta intravénásan adott tocilizumabbal (8 mg/ttkg) vagy AZT-val (2–3 mg/ttkg naponta)51. A tocilizumabkarban a betegek 85%-a, az azathioprinkarban 90%-uk volt AQP4-ellenanyag-pozitív. Szinte minden beteg kapott immunszuppresszív kezelést a tanulmány előtt, ezt a tocilizumabkarban 12 héten belül abba kellett hagyni, míg az AZAkarban a 24. héttől zajlott monoterápia. Az elsődleges végpont, a relapsusig eltelt idő hoszszabb volt a tocilizumabterápia kapcsán (78,9 vs. 56,7 hét, HR 0,24, p = 0,0026). A tocilizumabbal kezelt betegek 14%-ánál fordult elő relapsus az AZA-betegek 47%-ával szemben, vagyis a kockázatcsökkenés 76% volt (HR 0,24, p < 0,0001). A tocilizumab a betegek 50%-ában csökkentette az AQP4-ellenanyag-szintet, míg az AZA esetében ez nem változott. A 24 hetes megerősített rokkantságcsökkenés (CDW) 78%-kal csökkent az AZA-hoz képest. A tocilizumab hatékony volt az egyéb autoimmun kórképekkel társuló NMOSD-ben is. Míg a mellékhatásprofil általánosságban nem különbözött, néhány mellékhatás gyakoribb volt az AZAkezelésnél: ALT-emelkedés (46 vs. 31%), felső légúti infekció (39 vs. 29%), húgyúti infekció (36 vs. 29%), leukopenia (39% vs. 7%), hányinger (32% vs. 14%). Mindkét csoportban meghalt egy beteg: myelitis miatt a tocilizumabkarban, listeriosis miatt az AZA-karban. Prospektív és retrospektív terhességi adatok körülbelül 300 betegnél állnak rendelkezésre, de a betegek közel harmadát egyéb immunszuppresszívumokkal is kezelték, döntően az első trimeszterben, amikor az ellenanyagok a placentán nem jutnak még át. Az NMOSD szakértői javaslatok terhesség alatt súlyos NMOSD-ben és szoptatás alatt szoros monitorozással javasolják22, 33–35, míg az ACR fogamzásig és szoptatás alatt megfontolásokkal javasolja reumatológiai kórképekben36.

4. ábra. A tocilizumab és a satralizumab eltérô intracelluláris metabolizációja és féléletideje. A tocilizumab az IL-6-receptorhoz kötôdik, ami ennek hatására internalizálódik. Az endoszómák savas környezetében a tocilizumab-IL6R komplex disszociálódik, és lebomlik. A satralizumab ezzel szemben a disszociációt követôen nem bomlik le, hanem a neonatalis Fc-receptorhoz kötôdve kikerül a sejtbôl. Ezért féléletideje hosszabb, és havonta subcutan injekcióként adható, szemben az infúzióban adagolt tocilizumabbal. (Az ábra Biorender programmal készült.)
A satralizumab egy új IL-6R ellenanyag, melynek módosított szerkezete eltér a tocilizumabtól; alacsony pH-n csökken az affinitása, ezért az endoszómák savas környezetében a kötődést követően internalizált satralizumab disszociálódik a receptortól, és nem bomlik le, hanem az Fc-receptorokhoz kötődve ismét kikerül a sejtből22, 48. A tocilizumabhoz képest hosszabb féléletideje megnyújtott subcutan adagolást tesz lehetővé (4. ábra).
A két III. fázisú tanulmány (3. ábra) alapján az FDA és az EMA elfogadta a satralizumabot az AQP4-ellenanyag-pozitív NMOSD kezelésére. A betegek mindkét kettős vak placebokontrollált tanulmányban 120 mg satralizumabot kaptak subcutan havonta (az első hónapban két hetente) monoterápiában (SAkuraStar) vagy hozzáadott, kombinációs terápiában (SAkuraSky)52, 53. A két tanulmányban összesen 188 beteget kezeltek, fiatal és idős beteget egyaránt (13–74 éves), és minden egyes relapsust bizottság validált. A beválasztási diagnózis a 2015 IPND-kritériumoknál szigorúbb, 2006 Wingerchuk-kritériumon alapult, ami az opticus neuritis és a myelitis jelenlétét egyaránt megköveteli az AQP4-ellenanyag-pozitív betegekben is. RTX-kezelés a megelőző 6 hónapban kizáró kritérium volt, és a beválasztás megkövetelt az előző évben legalább egy relapsust mindkét tanulmányban.
A SAkuraSky vizsgálatban (3. ábra) körülbelül a betegek fele a kezelt és a placebokarban egyaránt AZA-t vagy MMF-et (szteroiddal vagy a nélkül) is kapott, azaz a satralizumabot hozzáadott kezelésként értékelték53. A kettős vak fázist a tervezésnek megfelelően 26 relapsus után felfüggesztették, a betegek nyitott fázisban folytathatták a kezelést; a medián kezelési periódus 143 hét volt. A relapsuskockázat csökkenése az 55 AQP4-szeropozitív betegben 79% volt (HR 0,21): a satralizumabbal kezelt betegek 11%-ánál, míg a placebokarban 43%-nál jelentkeztek relapsusok. A 96. hétnél az aktív karban a szeropozitív betegek 92%-a, a placebokarban 53%-uk volt relapsusmentes. A terápia nem volt hatékony a 28 AQP4-ellenanyag-szeronegatív betegben, ez a teljes kezelt populációban csökkentette a statisztikai hatékonyságot. A mellékhatások tekintetében nem volt különbség, és egy beteg sem halt meg. A satralizumabterápiát 3, a placebót 10 beteg függesztette fel.
A SAkuraStar III. fázisú vizsgálatban (3. ábra) a betegek satralizumab-monoterápiát vagy placebót kaptak 1,5 évig a kettős vak fázisban, majd ezt követően nyitott tanulmányban kezelték őket. A 64 AQP4-ellenanyag-pozitív betegben a satralizumabkar 22%-ánál, a placebokar 57%-ánál jelentkezett relapsus (74%-os csökkenés, HR: 0,26), és 96 hét kezelés után a satralizumabbal kezelt szeropozitív betegek 77%-a, míg a placebóval kezeltek 41%-a volt relapsusmentes. A terápia ebben a tanulmányban sem volt hatékony a 31 AQP4-ellenanyagszeronegatív betegben, ez a teljes kezelt populációban a statisztikai hatékonyságot itt is csökkentette. A súlyos mellékhatások aránya hasonló volt, és egy beteg sem halt meg.
Összefoglalva, a három II/III. fázisú tanulmány az anti-IL6R ellenanyag (tocilizumab, satralizumab) hatékonyságát jelzi AQP4-ellenanyag-pozitív betegekben monoterápiában és kombinációban egyaránt. A satralizumab terhességi megfontolásai valószínűleg hasonlóak lehetnek a tocilizumabhoz, bár satralizumabbal egyelőre nem állnak rendelkezésre adatok.
Komplementantagonizálás
A komplementaktiváció az NMOSD patogenezisében központi szerepet játszik: a laesiókban terminális komplementkomponensek mutathatók ki, és az AQP4-ellenanyag patogenecitását in vivo és in vitro modellekben a komplement markánsan növeli (1. ábra)4, 22.
Az eculizumab humanizált monoklonális IgG2/ IgG4 ellenanyag, ami a C5 komponenst támadja, és meggátolja a gyulladáskeltő C5a, valamint a membránattakkomplex létrejöttében fontos C5b képződését (1. és 3. ábra). Ennek következtében csökken a perifériás adaptív és ősi immunválasz, és az astrocyta-laesio a központi idegrendszerben22, 54.
Az eculizumabot az FDA és az EMA elfogadta az AQP4-ellenanyag-pozitív NMOSD kezelésére, valamint alkalmazható paroxysmalis nocturnalis haemoglobinuriában (PNH) és myasthenia gravisban (MG) is. A nyitott, egyéves, II. fázisú vizsgálatban 14 betegből 12 beteg relapsusmentes volt, míg a kezelés abbahagyása után öt betegnél fordult elő relapsus. Egy betegnél Meningococcus-szepszis jelentkezett55.
A PREVENT III. fázisú, kettős vak, placebokontrollált tanulmányban 143 AQP4-ellenanyagpozitív beteget randomizáltak 2:1 arányban eculizumab- (96 beteg, 900 mg hetente 4 hétig, majd 1200 mg kéthetente) vagy placeboterápiára (3. ábra)56. A beválasztási kritérium itt is a Wingerchuk 2006 diagnosztikai kritérium volt13. A tanulmányban nagyon aktív betegeket kezeltek, akiknél az előző évben legalább két relapsus, vagy előző két évben legalább három relapsus jelentkezett, melyekből egy a megelőző évben történt. A betegek 76%-a folytatta a megelőző immunszuppresszív terápiát is. A betegek körülbelül egyharmada legalább 3 hónappal korábban abbahagyva RTX-et kapott az eculizumab előtt. A kettős vak terápiát a tervezésnek megfelelően az első 23 relapsus után terminálták, és a betegek nyitott tanulmányban folytatták a kezelést.
Az eculizumabbal kezelt betegek 3%-ánál, míg a placebóval kezeltek 42%-ánál fordult elő relapsus (94%-os kockázatcsökkenés, HR: 0,06, p < 0,001); a monoterápiával kezelt 21 beteg egyikénél sem jelentkezett relapsus. Az eculizumabkarban gyakoribb volt a felső légúti infekció, és egy beteg, aki AZA mellé kapott eculizumabot, meghalt pulmonalis empyema miatt. A kiterjesztett nyitott és a kettős vak fázis közös adatait nemrég közölték: a nyitott fázisban 72 beteg az eculizumabkarból és 33 beteg a placebokarból folytatta az eculizumabkezelést (119 beteg)57. A 192. hétnél a betegek 94,4%-a relapsusmentes volt, és a korábban placebo add-on terápiával kezelt betegek relapsusrátája a nyitott fázisban hasonló lett a korábban is eculizumabbal kezelt betegekéhez. A nyitott fázisban a betegek 37%-a abbahagyta az eculizumab mellett alkalmazott egyéb immunszuppresszív kezelést. A kezelés előtt a betegeket Meningococcus ellen vakcinálni kell.
Limitált terhességi adatok PNH-ban, atípiás haemolyticus uraemiás szindrómában és HELLP szindrómában állnak rendelkezésre22. Az újszülöttek komplementfunkciója valószínűleg megtartott, a koncentráció az anyatejben is alacsony, így feltehetően relatíve biztonságos terápia NMOSD-terhességben is22, 33.
B-sejt-depletio
A B-sejtek szerepe NMOSD-ben magába foglalja az antigénprezentációt és így a T-sejtek aktiválását, a citokintermelést és a CD19+ plazmasejtek/ plazmablasztok ellenanyag-termelését (1. ábra). A rituximab (RTX) a CD20+ sejtpopulációt depletálja, ami érinti a késői pro-B-sejtektől a korai plazmablasztokig a B-sejteket, valamit a T-sejtek egy kis százalékát.
Az elmúlt 15 évben több retrospektív eset-kohort mutatta a kezelés hatékonyságát NMOSD-ben, de EMA- vagy FDA-javaslat nem áll rendelkezésre. A Johns Hopkins Kórház és a Mayo Klinika 10 éves anyagában az ARR csökkenése elérte a 88%-ot, és ez hasonló volt egy 21 olasz centrum 127 betegében észlelt 84%-os relapsusráta-csökkenéshez két év kezelés után29, 58. Hosszú távon a betegek 70%-a relapsusmentes volt59. Retrospektív analízisekben és egy egyéves nyitott tanulmányban szignifikánsan hatékonyabb volt az AZA-nál, és 33%-os hatástalansága is közel kétszer alacsonyabb volt (53%)28–32. Metaanalízisek szintén az éves relapsusráta csökkenését mutatták (–1,57, –1,56, –0,79)60–62.
A RTX optimális adagolása és dózisa azonban NMOSD-ben nem egyértelmű. A legtöbb kohortban a vasculitisprotokollt alkalmazzák (1000 mg 6 havonta, az első két hétben 1000-1000 mg-mal indítva), de egyes adatok szerint a CD27+ memóriaB-sejtek monitorozásán alapuló adagolás alacsonyabb dózist tesz lehetővé. A relapsus kockázata emelkedik a memória-B-sejtek repopulációját követően, és a cél a 0% perifériás CD19+ B-sejt-arány fenntartása. A relapsus kockázata szignifikánsan nő, ha a CD19+ sejtszám 0,5%-nál magasabb (vagy a CD27+ populáció 0,05%-nál magasabb), ezért minimum a 0,1%-os CD19+-céltartományt célszerű fenntartani63.
Hosszú távon a betegek 64%-ában alakul ki hypogammaglobulinaemia; a visszatérő infekciókkal társuló, 5 g/l alatti IgG havonta 0,4 g/ttkg kiegészítő IVIG-kezelést igényel63, 64. VZV- és Pneumococcus-vakcinálás javasolt a hosszú távú RTX előtt; a 65 évesnél idősebb betegekben VZV-vakcinálás szükséges még akkor is, ha anti-VZV szeropozitívak63.
A RIN-1 randomizált, kettős vak, III. fázisú tanulmányban 38 beteget randomizáltak placebovagy RTX-kezelésre (19 beteg) (3. ábra)65. A betegek először 4 héten át heti 375 mg/m2 RTX-ot, majd 24 és 48 hét múlva a betegek 2 hét különbséggel újabb 1000 mg RTX-et kaptak. Valamennyi beteg orális szteroidterápiában is részesült. Beválasztási kritérium volt az AQP4-elleanyag-pozitivitás az anamnézisben myelitisszel vagy opticus neuritisszel, de a betegek 29%-a AQP4-ellenanyagnegatív volt a terápia kezdetén. Az RTX-szel kezelt betegeknél nem fordult elő relapsus 72 hét alatt, szemben a 7 relapsussal (37%) a placebokarban (p = 0,0058). Az inebilizumab humanizált IgG1 monoklonális ellenanyag, ami a CD19+ B-sejteket depletálja, így az RTX-szel ellentétben az ellenanyag-termelő plazmasejteket is. Az FDA elfogadta az inebilizumabot az AQP4-ellenanyag-pozitív NMOSD kezelésére, míg az EMA orphan kezelési státuszt adott neki (1. és 3. ábra)22.
Az N-MOmentum kettős vak, placebokontrollált II/III. fázisú tanulmányban 230 beteget randomizáltak 3:1 arányban inebilizumab- vagy placebo-monoterápiára (3. ábra)66. A betegek a 2006 Wingerchuk-kritériumot teljesítették, és 92%-uk volt AQP4-ellenanyag-szeropozitív. A kettős vak fázis 197 napig, vagy az NMOSD relapsusáig, vagy a beválasztás befejezéséig tartott, azt követően a betegek nyitott fázisba kerültek; 169 inebilizumabbal kezelt beteg és 54 placebóval kezelt beteg fejezte be a tanulmányt. A betegek kétharmada az inebilizumab előtt egyéb immunszuppressziót kapott, melyet legalább 3 hónappal korábban fel kellett függeszteni. Emiatt a kezelés kezdetén a relapsusok minimalizására napi 20 mg prednisolont adtak, melyet 21 nap alatt leépítettek. Az inebilizumab dózisa összesen 600 mg volt két adagban (1. és 15 nap).
Az inebilizumab szignifikánsan csökkentette az első relapsusig eltelt időt (p < 0,0001). Az inebilizumabkarban a betegek 12%-ánál, a placebokarban a betegek 39%-ánál jelentkezett relapsus (HR: 0,27, p < 0,0001). A szeropozitív populációban a HR 0,23 volt, azaz 77%-os kocskázatcsökkenést értek el. Szignifikánsan csökkent az EDSS-rosszabbodás (p = 0,0049), az új MRI-laesiók száma (p = 0,0034) és a hospitalizáció (p = 0,01)66, 67. A tanulmány további analízise jelezte, hogy a szérum magas GFAP-koncentrációja háromszoros kockázatot jelentett relapsusra, és a relapsussal kapcsolt sGFAP-emelkedés elsősorban a placebocsoportban fordult elő68.
A mellékhatások, súlyos mellékhatások, infekciók aránya hasonló volt a két karban, malignitás nem fordult elő. Két beteg halt meg a nyitott fázisban: egy beteg inebilizumabot kapott, és 9 nappal később epilepsziás rohamban halt meg. A PML lehetősége felmerült, de egyértelműen bizonyítani nem lehetett. Hat hónap kezelés után az immunglobulinszint körülbelül 10%-kal csökkent, az IgM kifejezettebben, hasonlóan a RTX hatásához. Az FDA megköveteli az immunglobulinszint monitorozását.
A rendelkezésre álló adatok szerint az RTX fokozza a koraszülöttség és a spontán abortusz kockázatát, de számos beteg a tanulmányokban és regiszterekben egyéb immunszuppresszív terápiában is részesült22, 33–35, 68. Limitált adat SM-ben és NMOSD-ben is rendelkezésre áll, és az újszülöttek potenciális, reverzibilis hematológiai abnormalitásán kívül egyéb probléma nem jelentkezett. A többi monoklonális ellenanyaghoz hasonlóan a placentán az első trimeszterben nem jut át. Az ACR- és NMOSD-szakértői javaslat a koncepcióig és ha szükséges, a terhesség alatt is javasolja22, 33–36. Ha a beteg a tervezett RTX előtti és utáni 2 hónapban, azaz egy 4 hónapos időtartam alatt teherbe esik, az alkalmazott RTX az első trimeszterben biztonságos, és a további két trimeszter alatt csökkenti az aktivitás kockázatát. Az ACR evidenciák alapján javasolja az RTX adagolását szoptatás alatt, míg az NMOSD-szakértők kondíciókkal22, 33–36. Amennyiben a beteg a 2–3. trimeszter alatt kap RTX-et, az újszülött immunglobulin- és B-sejt-koncentrációját ellenőrizni kell, és szükség esetén ehhez kell igazítani a vakcinálását. Inebilizumabbal kapcsolatban terhességi adatok nem állnak rendelkezésre, de a megfontolások hasonlóak lehetnek az RTX-hez.
A MOGAD kezelése
A szeronegatív NMOSD körülbelül 25%-ában mutatható ki MOG-ellenanyag, a klinikai spektrum
azonban tágabb, mint az NMOSD fenotípus; gyakoribb a kétoldali papillitis, a gerincvelő distalis részének érintettsége és főleg gyermekekben az ADEM-szerű klinikai kép (1. táblázat). A MOGAD terápiája eltér az NMOSD és az SM kezelésétől. A betegeknek csak körülbelül a fele relapszáló; ez, és a gyermekkori megjelenés bonyolítja a fenntartó immunszuppresszív terápia kérdését. A kezelési algoritmust tovább befolyásolja az NMOSD-nél jobb prognózis és az ellenanyag spontán vagy terápiára történő eltűnése.
Egy a közelmúltban közölt nemzetközi felmérés tükrözte a heterogén megközelítést, a neurológusok és gyermekneurológusok közötti különbséget71. A felmérés azt is jelezte, hogy felnőtt betegeknél első vonalas fenntartó kezelésként az AZA és az MMF a leggyakoribb, második vonalban pedig az RTX71. Újabb adatok azonban megkérdőjelezik az RTX optimális hatékonyságát MOGAD-ban, mert 101 relapszáló betegnél a relapsusráta csökkenése csak 37% volt, és 2 év kezelés után csak a betegek 33%-a maradt relapsusmentes72. Többközpontú, retrospektív, 70 beteget bevonó tanulmányban a relapsusarány 74% volt MMF-nél (ARR 0,67), 61% RTXnál (ARR 0,59), 59% AZA-nál (ARR 0,2) és 20% IVIG-nél (ARR 0), míg az SM-terápiával kezelt 9 beteg mindegyikénél relapsus jelentkezett (ARR 1,5)73. Az SM-terápiák ineffektivitását a dán kohort is kimutatta15. Kis kohortok alapján az anti-IL-6R tocilizumab hatékony lehet relapszáló vagy egyéb kezelésre rosszul reagáló MOGAD-ban is74, 75.
A MOGAD további jellegzetessége a szteroidra adott gyors és hatékony válasz, esetenként a szteroidfüggőség (CRION)76. Ezért a MOGAD-relapsust 3–5 napig naponta adott 500–1000 mg methylprednisolonnal érdemes kezelni, illetve súlyos, nem reagáló relapsusban PE is alkalmazható. Míg NMOSD-ben a PE + szteroid kombináció hatékonyabb a szteroid-monoterápiával szemben77, 78, erre MOGAD-ban nincs adat. A relapsus lökésterápiája után az egyre inkább elfogadott protokoll orális szteroidot javasol 3–6 hónap alatt leépítve, majd ezt követően, amennyiben szükséges, megfontolható a fenti immunszuppresszívumok beállítása: például ha a betegnek újabb relapsusa jelentkezett vagy súlyos volt a relapsusa maradványtünetekkel79, 80.
A MOG-ellenanyag eltűnhet a szteroidkezelés vagy akár a hosszú immunszuppresszió alatt, ezért érdemes évente tesztelni; tartós negativitás esetén a terápia leállítható. Provokáló faktor azonban, például vakcinálás ismét szerokonverziót eredményezhet (nem publikált saját eset, SARS-CoV-2-vakcina után).
Összefoglalás
A tradicionális orális immunszuppresszánsok közül az AZA és az MMF az elsősorban alkalmazott NMOSD-terápia. E kezelések off-label terápiák, és az evidenciákon alapuló monoklonális ellenanyagterápiákkal szemben kevésbé szelektívek, lassabban hatnak, és a kezelés kezdetén szteroidkombinációt igényelnek. Az AZA-t a nyílt, randomizált II. fázisú TANGO tanulmányban hasonlították az IL6R-ellenanyag tocilizumabhoz, és egy nyílt iráni tanulmányban az RTX-hez, ezekben a hatékonysága alacsonyabb volt28. Emellett metaanalízis- és kohorttanulmányok azt sugallják, hogy az AZA kevésbé hatékony, mint az RTX, míg az MMF hatékonysága az RTX-éhez hasonló; a betegek legkevésbé az AZA-t és leginkább az MMF-et tolerálják29–32. Ugyanakkor bármelyik irányú váltás hatékony lehet, akár RTX-ről AZA-ra is29.
Az új II/III. fázisú tanulmányok első alkalommal nyújtanak lehetőséget evidenciaalapú kezelésre NMOSD-ben, mivel az eddig alkalmazott kezelések (például AZA, MMF, RTX) off-label terápiák. Az FDA elfogadta az eculizumabot (anti-C5), a satralizumabot (anti-IL6R) és az inebilizumabot (anti-CD19) az AQP4-ellenanyag-pozitív NMOSD kezelésére, míg az EMA elfogadta az eculizumabot, a satralizumabot, és orphan státuszt adott az inebilizumabnak. Az IL-6 (satralizumab) és a komplement útvonal (eculizumab) blokkolása új terápiás stratégiát is jelent a hagyományos immunszuppresszánsok és a már alkalmazott off-label RTX (B-sejt-depletálás) mellett.
A klinikai tanulmányok tervezése azonban különböző, így az új monoklonális ellenanyagok relatív hatékonysága nem hasonlítható össze. Az összes tanulmány time-to-event volt, azaz meghatározott relapsusszám elérésig tervezték, de más volt a szeronegatív betegek aránya vagy kizárása (eculizumab), a megelőző és társuló kezelés, a diagnosztikai és aktivitási kritérium a beválasztáskor. A satralizumab- és inebilizumab-tanulmányokban relapsusbizottság értékelt minden egyes relapsust a tanulmány kezdetétől, míg az eculizumabtanulmányban a bizottságot a tanulmány közben vezették be. Figyelembe véve az NMOSD ritkaságát és a hatékony terápiák közötti statisztikai különbség leméréséhez szükséges nagy betegszámot, fej-fej melletti tanulmányok tervezése valószínűtlen.
Bár a betegek közel kétharmada az új ellenanyag-terápiák előtt egyéb immunszuppresszív kezelésben részesült, az NMOSD szakértői panelek javasolják az új monoklonális ellenanyag-terápiákat első vonalban is22, 71. Míg csak a TANGO tanulmány hasonlította össze a tocilizumabot (antiIL6R) azathioprinnal, a többi tanulmányban a hozzáadott ellenanyag-terápiák (satralizumab, eculizumab) hatékonyabbak voltak kombinációban, mint a placebokombináció, így valószínűleg második vonalban is jól alkalmazhatók. Ugyanakkor az antiCD20 RTX, az anti-CD19 inebilizumab és az antiIL6R satralizumab monoterápiában is hasonlóan hatékony volt. A legaktívabb betegeket az eculizumab PREVENT tanulmányban kezelték, a satralizumab SAkuraSky vizsgálatba 18 év alatti betegeket is bevontak 12 éves korig, és a szigorúbb Wingerchuk-kritériumokat a PREVENT (eculizumab), N-MOmentum (inebilizumab) és SAkura (satralizumab) tanulmányokban alkalmazták.
Az AQP4-ellenanyag-szeronegatív betegekben az új ellenanyag-terápiák hatása limitált, és sem az FDA, sem az EMA nem javasolja ezeket: a satralizumab a két SAkura-tanulmányban e betegeknél nem volt hatásos, az eculizumabot nem vizsgálták, és az inebilizumabot csak nagyon kisszámú betegben próbálták. Továbbá, míg az AQP4-ellenanyagszeronegatív betegeket valószínűleg inkább kezelik AZA-val és MMF-fel, mint RTX-szel, a szerostátusz önmagában nem befolyásolta a hagyományos immunszuppresszánsokra adott választ29, 81.
A különböző ellenanyag-terápiák mellékhatásprofilja kissé különbözik. Az eculizumab alkalmazása előtt a betegeket Meningococcus ellen vakcinálni kell. Tartós anti-CD20-terápiák előtt VZV- és Pneumococcus-vakcinálás szükséges. Az inebilizumab a korábbi SM-tanulmányban jobban csökkentette az immunglobulinszintet, mint az RTX. A satralizumab neutropeniát okozhat.
A neutralizáló ellenanyagok kialakulása az új humanizált ellenanyag-terápiáknál valószínűleg minimális, az inebilizumabnál 3% volt. A kiméra RTX-nél az SM-betegek egyharmadában alakultak ki anti-RTX ellenanyagok, de ezek klinikai hatása nem egyértelmű. Az eculizumab, az RTX és valószínűleg az inebilizumab csökkenti a vakcinák hatékonyságát. Az ellenanyag-terápiák adagolása is különbözik. Az eculizumab (anti-C5) kéthetente történő intravénás adagolása szükséges és fontos, mivel a komplementszint gyorsan rendeződik a terápia kihagyása esetén. Ez kifejezett kooperációt igényel a beteg és az orvos részéről. A satralizumab havonta adagolható subcutan injekcióban, ami kényelmes a beteg számára. Szintén könnyen, az RTX-hez hasonló séma szerint adható az inebilizumab.
A klasszikus immunszuppresszánsok terhesség alatt nem adhatók az AZA kivételével; kötelező az MTX- és a ciklofoszfamidleállítás a tervezett terhesség előtt legalább 3 hónappal, az MMF leállítása legalább 6 héttel előtte. Ezért e kezelések nem javasoltak fogamzóképes NMOSD-s nőbetegekben. Az új ellenanyag-terápiák e vonatkozásban is új stratégiát jelenthetnek, mivel az első trimeszterben a placentán nem jutnak át. A legismertebb és legbiztonságosabb közülük jelenleg az RTX, de a többi terápia relatív biztonságossága is valószínű.
A MOGAD terápiája az NMOSD-től eltérő, és orális szteroid „bridge” javasolt a tartós immunszuppresszió eldöntése előtt. Az optimális protokoll megállapítása további nemzetközi vizsgálatokat és regiszteradatokat igényel. Klinikai tanulmányok szervezése MOGAD betegekkel is zajlik, de a monofázisos lefolyás és az ellenanyagok eltűnése bonyolítja a terápia kérdését.
NYILATKOZAT
A szerző tagja volt a SAkuraStar és SAkuraSky III. fázisú klinikai vizsgálatok relapsusbizottságának, és részt vett a satralizumab EMA-véleményezésének folyamatában. A közlemény megírását a Roche támogatta, de a tartalmat nem befolyásolta, az a szerző véleményét tükrözi.
IRODALOM
1. Holroyd KB, Manzano GS, Levy M. Update on neuromyelitis optica spectrum disorder. Curr Opin Ophthalmol 2020; 31:462-8.
https://doi.org/10.1097/ICU.0000000000000703
2. Papp V, Magyari M, Aktas O, et al. Worldwide incidence and prevalence of neuromyelitis optica: a systematic review. Neurology 2021;96:59-77.
3. Papp V, Iljicsov A, Rajda C, et al. A population-based epidemiological study of neuromyelitis optica spectrum disorder in Hungary. Eur J Neurol 2020;27:308-17.
4. Herwerth M, Kalluri SR, Srivastava R, et al. In vivo imaging reveals rapid astrocyte depletion and axon damage in a model of neuromyelitis optica-related pathology. Ann Neurol 2016;79:794-805.
https://doi.org/10.1002/ana.24630
5. Uzonyi B, Szabó Z, Trojnár E, et al. Autoantibodies against the complement regulator factor H in the serum of patients with neuromyelitis optica spectrum disorder. Front Immunol 2021;12:660382.
https://doi.org/10.3389/fimmu.2021.660382
6. Mader S, Kümpfel T, Meinl E. Novel insights into pathophysiology and therapeutic possibilities reveal further differences between AQP4-IgG- and MOG-IgG-associated diseases. Curr Opin Neurol 2020;33:362-71.
https://doi.org/10.1097/WCO.0000000000000813
7. Fujihara K, Bennett JL, de Seze J, Haramura M, Kleiter I, Weinshenker BG, et al. Interleukin-6 in neuromyelitis optica spectrum disorder pathophysiology. Neurol Neuroimmunol Neuroinflamm 2020;7:e841.
https://doi.org/10.1212/NXI.0000000000000841
8. Zeka B, Hastermann M, Hochmeister S, et al. Highly encephalitogenic aquaporin 4-specific T cells and NMOIgG jointly orchestrate lesion location and tissue damage in the CNS. Acta Neuropathol 2015;130:783-98.
https://doi.org/10.1007/s00401-015-1501-5
9. Varrin-Doyer M, Spencer CM, Schulze-Topphoff U, et al. Aquaporin 4-specific T cells in neuromyelitis optica exhibit a Th17 bias and recognize Clostridium ABC transporter. Ann Neurol 2012;72:53-64.
https://doi.org/10.1002/ana.23651
10. Kimura A, Kishimoto T. IL-6: regulator of Treg/Th17 balance. Eur J Immunol 2010;40:1830-5.
11. Wynford-Thomas R, Jacob A, Tomassini V. Neurological update: MOG antibody disease. J Neurol 2019;266:1280-6.
https://doi.org/10.1007/s00415-018-9122-2
12. O’Connell K, Hamilton-Shield A, Woodhall M, et al. Prevalence and incidence of neuromyelitis optica spectrum disorder, aquaporin-4 antibody-positive NMOSD and MOG antibody-positive disease in Oxfordshire, UK. J Neurol Neurosurg Psychiatry 2020;91:1126-8.
https://doi.org/10.1136/jnnp-2020-323158
13. Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015;85:177-89.
https://doi.org/10.1212/WNL.0000000000001729
14. Jarius S, Paul F, Aktas O, et al. MOG encephalomyelitis: international recommendations on diagnosis and antibody testing. J Neuroinflammation 2018;15:134.
https://doi.org/10.1186/s12974-018-1144-2
15. Papp V, Langkilde AR, Blinkenberg M, Schreiber K, Jensen PEH, Sellebjerg F. Clinical utility of anti-MOG antibody testing in a Danish cohort. Mult Scler Relat Disord 2018;26:61-7.
https://doi.org/10.1016/j.msard.2018.09.010
16. Klawiter EC, Bove R, Elsone L, et al. High risk of postpartum relapses in neuromyelitis optica spectrum disorder. Neurology 2017;89:2238-44.
https://doi.org/10.1212/WNL.0000000000004681
17. Banwell B, Marrie RA. Increased relapse rate during pregnancy and postpartum in neuromyelitis optica. Neurology 2017;89:2220-1.
https://doi.org/10.1212/WNL.0000000000004721
18. Collongues N, Rego DCA, Bourre B, et al. Pregnancy in patients with AQP4-Ab, MOG-Ab, or double-negative neuromyelitis optica disorder. Neurology 2021;96:e2006-e2015.
https://doi.org/10.1212/WNL.0000000000011744
19. D’Souza R, Wuebbolt D, Andrejevic K, et al. Pregnancy and neuromyelitis optica spectrum disorder – reciprocal effects and practical recommendations: a systematic review. Front Neurol 2020;11:544434.
https://doi.org/10.3389/fneur.2020.544434
20. Nour MM, Nakashima I, Coutinho E, et al. Pregnancy outcomes in aquaporin-4-positive neuromyelitis optica spectrum disorder. Neurology 2016;86:79-87.
https://doi.org/10.1212/WNL.0000000000002208
21. Saadoun S, Waters P, Leite MI, et al. Neuromyelitis optica IgG causes placental inflammation and fetal death. J Immunol 2013;191:2999-3005.
https://doi.org/10.4049/jimmunol.1301483
22. Holmøy T, Høglund RA, Illes Z, Myhr KM, Torkildsen Ø. Recent progress in maintenance treatment of neuromyelitis optica spectrum disorder. J Neurol 2020 Oct 3.
https://doi.org/10.1007/s00415-020-10235-5
23. Costanzi C, Matiello M, Lucchinetti CF, et al. Azathioprine: tolerability, efficacy, and predictors of benefit in neuromyelitis optica. Neurology 2011;77:659-66.
https://doi.org/10.1212/WNL.0b013e31822a2780
24. Bichuetti DB, de Oliveira EML, Oliveira DM, de Souza NA, Gabbai AA. Neuromyelitis optica treatment: analysis of 36 patients. Arch Neurol 2010;67:1131-6.
https://doi.org/10.1001/archneurol.2010.203
25. Elsone L, Kitley J, Luppe S, et al. Long-term efficacy, tolerability and retention rate of azathioprine in 103 aquaporin4 antibody-positive neuromyelitis optica spectrum disorder patients: a multicentre retrospective observational study from the UK. Mult Scler 2014;20:1533-40.
https://doi.org/10.1177/1352458514525870
26. Tahara M, Oeda T, Okada K, et al. Safety and efficacy of rituximab in neuromyelitis optica spectrum disorders (RIN-1 study): a multicentre, randomised, double-blind, placebocontrolled trial. Lancet Neurol 2020;19:298-306.
https://doi.org/10.1016/S1474-4422(20)30066-1
27. Zhang C, Zhang M, Qiu W, et al; TANGO Study Investigators. Safety and efficacy of tocilizumab versus azathioprine in highly relapsing neuromyelitis optica spectrum disorder (TANGO): an open-label, multicentre, randomised, phase 2 trial. Lancet Neurol 2020;19:391-401.
https://doi.org/10.1016/S1474-4422(20)30070-3
28. Nikoo Z, Badihian S, Shaygannejad V, Asgari N, Ashtari F. Comparison of the efficacy of azathioprine and rituximab in neuromyelitis optica spectrum disorder: a randomized clinical trial. J Neurol 2017;264:2003-9.
https://doi.org/10.1007/s00415-017-8590-0
29. Mealy MA, Wingerchuk DM, Palace J, Greenberg BM, Levy M. Comparison of relapse and treatment failure rates among patients with neuromyelitis optica: multicenter study of treatment efficacy. JAMA Neurol 2014;71:324-30.
https://doi.org/10.1001/jamaneurol.2013.5699
30. Torres J, Pruitt A, Balcer L, Galetta S, Markowitz C, Dahodwala N. Analysis of the treatment of neuromyelitis optica. J Neurol Sci 2015;351:31-5.
https://doi.org/10.1016/j.jns.2015.02.012
31. Jeong IH, Park B, Kim SH, Hyun JW, Joo J, Kim HJ. Comparative analysis of treatment outcomes in patients with neuromyelitis optica spectrum disorder using multifaceted endpoints. Mult Scler 2016;22:329-39.
https://doi.org/10.1177/1352458515587752
32. Huang W, Wang L, Zhang B, Zhou L, Zhang T, Quan C. Effectiveness and tolerability of immunosuppressants and monoclonal antibodies in preventive treatment of neuromyelitis optica spectrum disorders: A systematic review and network meta-analysis. Mult Scler Relat Disord 2019;35:246-52.
https://doi.org/10.1016/j.msard.2019.08.009
33. Mao-Draayer Y, Thiel S, Mills EA, Chitnis T, Fabian M, Katz Sand I, et al. Neuromyelitis optica spectrum disorders and pregnancy: therapeutic considerations. Nat Rev Neurol 2020;16:154-70.
https://doi.org/10.1038/s41582-020-0313-y
34. Borisow N, Hellwig K, Paul F. Neuromyelitis optica spectrum disorders and pregnancy: relapse-preventive measures and personalized treatment strategies. EPMA J 2018;9: 249-56.
https://doi.org/10.1007/s13167-018-0143-9
35. Shosha E, Pittock SJ, Flanagan E, Weinshenker BG. Neuromyelitis optica spectrum disorders and pregnancy: Interactions and management. Mult Scler 2017;23:1808-17.
https://doi.org/10.1177/1352458517740215
36. Sammaritano LR, Bermas BL, Chakravarty EE, et al. American College of Rheumatology Guideline for the Management of Reproductive Health in Rheumatic and Musculoskeletal Diseases. Arthritis Rheumatol 2020;72:529-56.
https://doi.org/10.1002/art.41191
37. Csépány T, Illés Z. Klinikai neuroimmunológia. Budapest: Medical Tribune; 2014.
38. Huang Q, Wang J, Zhou Z, et al. Low-dose mycophenolate mofetil for treatment of neuromyelitis optica spectrum disorders: a prospective multicenter study in South China. Front Immunol 2018;9:2066.
https://doi.org/10.3389/fimmu.2018.02066
39. Jacob A, Matiello M, Weinshenker BG, et al. Treatment of neuromyelitis optica with mycophenolate mofetil: retrospective analysis of 24 patients. Arch Neurol 2009;66:1128-33.
40. Huh SY, Kim SH, Hyun JW, et al. Mycophenolate mofetil in the treatment of neuromyelitis optica spectrum disorder. JAMA Neurol 2014;71:1372-8.
https://doi.org/10.1001/jamaneurol.2014.2057
41. Hoeltzenbein M, Elefant E, Vial T, et al. Teratogenicity of mycophenolate confirmed in a prospective study of the European Network of Teratology Information Services. Am J Med Genet A 2012;158A:588-96.
https://doi.org/10.1002/ajmg.a.35223
42. Kitley J, Elsone L, George J, et al. Methotrexate is an alternative to azathioprine in neuromyelitis optica spectrum disorders with aquaporin-4 antibodies. J Neurol Neurosurg Psychiatry 2013;84:918-21.
https://doi.org/10.1136/jnnp-2012-304774
43. Kim SH, Kim W, Park MS, Sohn EH, Li XF, Kim HJ. Efficacy and safety of mitoxantrone in patients with highly relapsing neuromyelitis optica. Arch Neurol 201168:473-9.
https://doi.org/10.1001/archneurol.2010.322
44. Yaguchi H, Sakushima K, Takahashi I, et al. Efficacy of intravenous cyclophosphamide therapy for neuromyelitis optica spectrum disorder. Intern Med 2013;52:969-72.
https://doi.org/10.2169/internalmedicine.52.7885
45. Xu Y, Wang Q, Ren HT, et al. Comparison of efficacy and tolerability of azathioprine, mycophenolate mofetil, and cyclophosphamide among patients with neuromyelitis optica spectrum disorder: A prospective cohort study. J Neurol Sci 2016;370:224-8.
https://doi.org/10.1016/j.jns.2016.09.035
46. Burt RK, Balabanov R, Han X, et al. Autologous nonmyeloablative hematopoietic stem cell transplantation for neuromyelitis optica. Neurology 2019;93:e1732-41.
https://doi.org/10.1212/WNL.0000000000008394
47. Rosso M, Saxena S, Chitnis T. Targeting IL-6 receptor in the treatment of neuromyelitis optica spectrum: a review of emerging treatment options. Expert Rev Neurother 2020; 20:509-16.
https://doi.org/10.1080/14737175.2020.1757434
48. Choy EH, De Benedetti F, Takeuchi T, Hashizume M, John MR, Kishimoto T. Translating IL-6 biology into effective treatments. Nat Rev Rheumatol 2020;16:335-45.
https://doi.org/10.1038/s41584-020-0419-z
49. Grøn KL, Arkema EV, Glintborg B, et al; ARTIS Study Group. Risk of serious infections in patients with rheumatoid arthritis treated in routine care with abatacept, rituximab and tocilizumab in Denmark and Sweden. Ann Rheum Dis 2019;78:320-27.
https://doi.org/10.1136/annrheumdis-2018-214326
50. Rutherford AI, Subesinghe S, Hyrich KL, Galloway JB. Serious infection across biologic-treated patients with rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register for Rheumatoid Arthritis. Ann Rheum Dis 2018;77:905-10.
https://doi.org/10.1136/annrheumdis-2017-212825
51. Zhang C, Zhang M, Qiu W, et al; TANGO Study Investigators. Safety and efficacy of tocilizumab versus azathioprine in highly relapsing neuromyelitis optica spectrum disorder (TANGO): an open-label, multicentre, randomised, phase 2 trial. Lancet Neurol 2020;19:391-401.
https://doi.org/10.1016/S1474-4422(20)30070-3
52. Traboulsee A, Greenberg BM, Bennett JL, et al. Safety and efficacy of satralizumab monotherapy in neuromyelitis optica spectrum disorder: a randomised, double-blind, multicentre, placebo-controlled phase 3 trial. Lancet Neurol 2020;19:402-12.
https://doi.org/10.1016/S1474-4422(20)30078-8
53. Yamamura T, Kleiter I, Fujihara K, et al. Trial of satralizumab in neuromyelitis optica spectrum disorder. N Engl J Med 2019;381:2114-24.
https://doi.org/10.1056/NEJMoa1901747
54. Schatz-Jakobsen JA, Zhang Y, Johnson K, Neill A, Sheridan D, Andersen GR. Structural basis for eculizumabmediated inhibition of the complement terminal pathway. J Immunol 2016;197:337-44.
https://doi.org/10.4049/jimmunol.1600280
55. Pittock SJ, Lennon VA, McKeon A, et al. Eculizumab in AQP4-IgG-positive relapsing neuromyelitis optica spectrum disorders: an open-label pilot study. Lancet Neurol 2013;12:554-62.
https://doi.org/10.1016/S1474-4422(13)70076-0
56. Pittock SJ, Berthele A, Fujihara K, et al. Eculizumab in aquaporin-4-positive neuromyelitis optica spectrum disorder. N Engl J Med 2019;381:614-25.
https://doi.org/10.1056/NEJMoa1900866
57. Wingerchuk DM, Fujihara K, Palace J, et al; PREVENT Study Group. Long-Term Safety and Efficacy of Eculizumab in Aquaporin-4 IgG-Positive NMOSD. Ann Neurol 2021;89:1088-98.
https://doi.org/10.1002/ana.26049
58. Novi G, Bovis F, Capobianco M, et al; iMUST group. Efficacy of different rituximab therapeutic strategies in patients with neuromyelitis optica spectrum disorders. Mult Scler Relat Disord 2019;36:101430.
59. Kim S-H, Jeong IH, Hyun J-W, et al. Treatment outcomes with rituximab in 100 patients with neuromyelitis optica: influence of FCGR3a polymorphisms on the therapeutic response to rituximab. JAMA Neurol 2015;72:989-95.
https://doi.org/10.1001/jamaneurol.2015.1276
60. Wang Y, Chang H, Zhang X, Yin L. Efficacy of rituximab in the treatment of neuromyelitis optica spectrum disorders: An update systematic review and meta-analysis. Mult Scler Relat Disord 2021;50:102843.
https://doi.org/10.1016/j.msard.2021.102843
61. Gao F, Chai B, Gu C, et al. Effectiveness of rituximab in neuromyelitis optica: a meta-analysis. BMC Neurol 2019;
19:36. https://doi.org/10.1186/s12883-019-1261-2
62. Damato V, Evoli A, Iorio R. Efficacy and safety of rituximab therapy in neuromyelitis optica spectrum disorders: a systematic review and meta-analysis. JAMA Neurol 2016;
73:1342-8. https://doi.org/10.1001/jamaneurol.2016.1637
63. Ciron J, Audoin B, Bourre B, et al; NOMADMUS group, under the aegis of OFSEP, SFSEP. Recommendations for the use of Rituximab in neuromyelitis optica spectrum disorders. Rev Neurol (Paris) 2018;174:255-64.
https://doi.org/10.1016/j.neurol.2017.11.005
64. Tallantyre EC, Whittam DH, Jolles S, et al. Secondary antibody deficiency: a complication of anti-CD20 therapy for neuroinflammation. J Neurol 2018;265:1115-22.
https://doi.org/10.1007/s00415-018-8812-0
https://doi.org/10.1007/s00415-018-8833-8
65. Tahara M, Oeda T, Okada K, et al. Safety and efficacy of rituximab in neuromyelitis optica spectrum disorders (RIN-1 study): a multicentre, randomised, double-blind, placebocontrolled trial. Lancet Neurol 2020;19:298-306.
https://doi.org/10.1016/S1474-4422(20)30066-1
66. Cree BAC, Bennett JL, Kim HJ, et al; N-MOmentum study investigators. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a doubleblind, randomised placebo-controlled phase 2/3 trial. Lancet 2019;394:1352-63.
https://doi.org/10.1016/S0140-6736(19)31817-3
67. Marignier R, Bennett JL, Kim HJ, et al; N-MOmentum Study Investigators. Disability Outcomes in the N-MOmentum Trial of Inebilizumab in Neuromyelitis Optica Spectrum Disorder. Neurol Neuroimmunol Neuroinflamm
2021;8:e978. https://doi.org/10.1212/NXI.0000000000000978
67. Aktas O, Smith MA, Rees WA, et al; N-MOmentum scientific group and the N-Momentum study investigators. Serum Glial Fibrillary Acidic Protein: A Neuromyelitis Optica Spectrum Disorder Biomarker. Ann Neurol 2021;89:895- 910.
https://doi.org/10.1002/ana.26067
68. Chakravarty EF, Murray ER, Kelman A, Farmer P. Pregnancy outcomes after maternal exposure to rituximab. Blood 2011;117:1499-506.
https://doi.org/10.1182/blood-2010-07-295444
69. Das G, Damotte V, Gelfand JM, et al. Rituximab before and during pregnancy: A systematic review, and a case series in MS and NMOSD. Neurol Neuroimmunol Neuroinflamm 2018;5:e453.
https://doi.org/10.1212/NXI.0000000000000453
70. Kümpfel T, Thiel S, Meinl I, et al. Anti-CD20 therapies and pregnancy in neuroimmunologic disorders: A cohort study from Germany. Neurol Neuroimmunol Neuroinflamm 2020;8:e913.
https://doi.org/10.1212/NXI.0000000000000913
71. Tugizova M, Vlahovic L, Tomczak A, Wetzel NS, Han MH. New therapeutic landscape in neuromyelitis optica. Curr Treat Options Neurol 2021;23:13.
https://doi.org/10.1007/s11940-021-00667-3
72. Whittam DH, Karthikeayan V, Gibbons E, et al. Treatment of MOG antibody associated disorders: results of an international survey. J Neurol 2020;267:3565-77.
https://doi.org/10.1007/s00415-020-10026-y
72. Whittam DH, Cobo-Calvo A, Lopez-Chiriboga AS, et al. Treatment of MOG-IgG-associated disorder with rituximab: An international study of 121 patients. Mult Scler Relat Disord 2020;44:102251. 73. Chen JJ, Flanagan EP, Bhatti MT, et al. Steroid-sparing maintenance immunotherapy for MOG-IgG associated disorder. Neurology 2020;95:e111-e120.
https://doi.org/10.1212/WNL.0000000000009758
74. Elsbernd PM, Hoffman WR, Carter JL, Wingerchuk DM. Interleukin-6 inhibition with tocilizumab for relapsing MOG-IgG associated disorder (MOGAD): A case-series and review. Mult Scler Relat Disord 2021;48:102696.
https://doi.org/10.1016/j.msard.2020.102696
75. Hayward-Koennecke H, Reindl M, Martin R, Schippling S. Tocilizumab treatment in severe recurrent anti-MOG-associated optic neuritis. Neurology 2019;92:765-7.
https://doi.org/10.1212/WNL.0000000000007312
76. Chalmoukou K, Alexopoulos H, Akrivou S, Stathopoulos P, Reindl M, Dalakas MC. Anti-MOG antibodies are frequently associated with steroid-sensitive recurrent optic neuritis. Neurol Neuroimmunol Neuroinflamm 2015;2:e131.
https://doi.org/10.1212/NXI.0000000000000131
77. Siritho S, Nopsopon T, Pongpirul K. Therapeutic plasma exchange vs. conventional treatment with intravenous high dose steroid for neuromyelitis optica spectrum disorders (NMOSD): a systematic review and meta-analysis. J Neurol 2020 Oct 10.
78. Abboud H, Petrak A, Mealy M, Sasidharan S, Siddique L, Levy M. Treatment of acute relapses in neuromyelitis optica: Steroids alone versus steroids plus plasma exchange. Mult Scler 2016;22:185-92.
https://doi.org/10.1177/1352458515581438
79. Wynford-Thomas R, Jacob A, Tomassini V. Neurological update: MOG antibody disease. J Neurol 2019;266:1280-6.
https://doi.org/10.1007/s00415-018-9122-2
80. Juryńczyk M, Jacob A, Fujihara K, Palace J. Myelin oligodendrocyte glycoprotein (MOG) antibody-associated disease: practical considerations. Pract Neurol 2019 19:187-95.
https://doi.org/10.1136/practneurol-2017-001787
81. Mealy MA, Kim SH, Schmidt F, et al. Aquaporin-4 serostatus does not predict response to immunotherapy in neuromyelitis optica spectrum disorders. Mult Scler 2018;24: 1737-42.
https://doi.org/10.1177/1352458517730131